Hukum dasar kimia adalah hukum yang digunakan untuk mendasari hitung an kimia dan hubungan kuantitatif dari reaktan dan produk dalam persamaan kimia.
PENCETUS
HUKUM DASAR KIMIA
Antoine Lavoiser
Hukum Ketetapan Massa
Joseph proust
Hukum Perbandingan Tetap
John Dalton
Hukum Perbandingan Berganda
J. L. Gay - Lussac
Hukum Perbandingan Volume
Praktikum Hukum Lavoisier
Sebelum membaca literasi mengenai hukum Lavoisier, lihatlah video praktikum ini.
Hukum Lavoisier juga dikenal sebagai hukum kekekalan massa. Teori ini dicetuskan oleh ilmuwan asal Prancis, Antoine Laurent Lavoisier. Hukum itu ditemukan saat Lavoisier saat membakar merkuri cair putih dengan oksigen hingga berubah menjadi merkuri oksida berwarna merah. Kemudian, Lavoisier juga memanaskan merkuri oksida merah itu sampai kembali terbentuk merkuri cari putih dan oksigen. Dalam penelitian itu Lavoisier lantas menemukan bahwa ada peran dari gas oksigen dalam reaksi pembakaran.
Massa oksigen pada saat proses pembakaran ternyata sama dengan massa oksigen yang terbentuk setelah merkuri oksida dipanaskan.
Bunyi dari Hukum Lavoisier adalah: "Massa total zat sebelum reaksi sama dengan massa total setelah zat reaksi.
Contoh soal:
5 gram Oksigen direaksikan dengan 5 gram logam Magnesium sehingga membentuk senyawa Magnesium oksida. Dari reaksi tersebut berapa massa magnesium oksida yang dihasilkan?Penyelesaian:
Mg + O2 → MgO
Massa zat sebelum reaksi = massa zat sesudah reaksi
Massa Mg + Massa O2 = Massa MgO
5 gram Mg + 5 gram O2 = 10 gram MgO
Jadi massa Magnesium oksida yang dihasilkan adalah sebanyak 10 gram
learn more
Contoh soal:
Sebuah oksigen memiliki massa 6 gram kemudian direaksikan dengan logam magnesium sehingga membentuk 8 gram senyawa oksida. Berapakah massa magnesium yang bereaksi?Penyelesaian:
Mg + O2 → MgO
Massa zat sebelum reaksi = massa zat sesudah reaksi
Massa Mg + Massa O2 = Massa MgO2
Massa Mg + 6 gram O2 = 8 gram MgO2
Massa Mg = 8 gram MgO2 - 6 gram O2
Massa Mg = 2 gram
Jadi massa logam Magnesium yang bereaksi sebanyak 2 gram
learn more
Praktikum Hukum Perbandingan Tetap
Hukum Proust juga dikenal sebagai “Hukum Perbandingan Tetap”. Ini dikarenakan pada 1799 Joseph Louis Proust menemukan bahwa setiap senyawa disusun oleh unsur dengan komposisi tertentu dan tetap. Oleh karena itu, hukum tersebut berbunyi:
"Perbandingan massa unsur-unsur setiap senyawa berisi komposisi tertentu dan tetap".
Salah satu contoh eksperimennya adalah reaksi unsur hidrogen dengan oksigen membentuk senyawa air dan kemudian hasilnya menunjukkan perbandingan massa hidrogen dengan oksigen beraksi tetap, yakni 1:8.

CONTOH SOAL
Massa karbon (C) dan oksigen (O) memiliki perbandingan 3:8. Jika karbon yang bereaksi 1,5 gram, berapa massa oksigen bereaksi dan massa karbondioksida yang terbentuk?
Penyelesaian:
Perbandingan Massa:
Karbon=3=1,5gram
Oksigen=8=?gram
Karbondioksida=11=?gram
Massa Oksigen = 8/3 × 1,5 gram = 4 gram
Massa Karbon dioksida = 11/3 × 1,5 = 5,5 gram.
Jadi massa oksigen bereaksi adalah 4 gram dan massa Karbondioksida terbentuk adalah 5,5 gram.
CONTOH SOAL 2
Senyawa karbon dioksida dibentuk dari unsur karbon dan oksigen dengan perbandingan massa karbon dan oksigen adalah 3 : 8. Jika unsur karbon yang bereaksi 1,5 gram, tentukan massa oksigen yang bereaksi dan massa karbon dioksida yang terbentuk!
Pembahasan:
Dari soal tersebut diketahui:


[[KLIK untuk unduh]]
Kerjakanlah soal berikut di kertas/ buku tulis kimiamu, lalu foto dan unggah hasilnya di LMS sebelum deadline
kertas/buku diKUMPULKAN SAAT HARI PERTAMA MASUK SEKOLAH ya...
Hukum Perbandingan Berganda
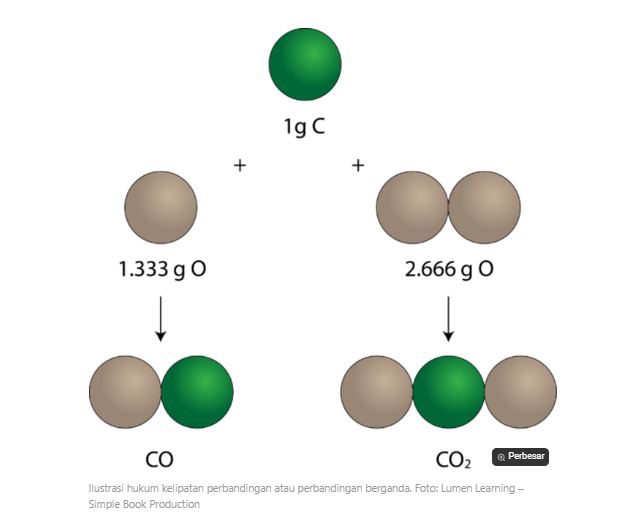
Hukum perbandingan berganda ditemukan John Dalton pada tahun 1803 yang menyatakan atau berbunyi, Jika dua buah unsur dapat membentuk lebih dari satu macam persenyawaan, jika perbandingan massa salah satu unsur dibuat sama, maka perbandingan massa unsur yang lainnya yaitu berbanding sebagai bilangan yang sederhana dan bulat.
Pengertian hukum perbandingan berganda apabila dua buah unsur bersenyawa, jenis persenyawaan yang terbentuk dapat berupa lebih dari satu.Misalnya sebagai contoh hukum perbandingan berganda dalton yaitu ketika hidrogen dan oksigen bergabung dapat terbentuk air (H2O) atau hidrogen peroksida (H2O2). Apabila massa hidrogen atau oksigen pada kedua unsur ini sama, perbandingan massa unsur satunya dapat dituliskan dalam perbandingan bilangan bulat yang sederhana. Inilah yang disebut sebagai ‘Hukum Perbandingan Berganda’.
contoh soal 1
Unsur A dapat membentuk 2 oksida. Salah satu oksida mengandung 10 gram oksigen yang bergabung dengan 1,26 gram A. Oksida kedua mengandung 30 gram oksigen yang bergabung dengan 2,52 gram A. Tunjukkanlah bahwa kedua oksida besi ini memenuhi Hukum Perbandingan Berganda.
Pembahasan:
Pertama-tama kita buat massa unsur oksigen pada oksida pertama dan kedua sama, kemudian massa unsur A mengikuti:

Misal, massa unsur oksigen dibuat sama, sehingga:

contoh soal 2
Dua buah senyawa oksida nitrogen (NxOy) yang tersusun atas unsur oksigen dan nitrogen dengan komposisi sebagai berikut.
 Tentukan perbandingan antara massa oksigen pada senyawa I dan II!
Tentukan perbandingan antara massa oksigen pada senyawa I dan II!
Pembahasan:
Untuk menentukan perbandingan massa oksigen pada kedua senyawa tersebuT, cukup melihat massa oksigen yang diketahui. Ternyata, cukup mudah menentukan perbandingannya ya, karena massa nitrogennya sudah sama. Secara matematis, dirumuskan sebagai berikut.

Jadi, perbandingan massa oksigen pada senyawa I dan II adalah 1 : 3.
[[KLIK untuk unduh]]
Kerjakanlah soal berikut di kertas/ buku tulis kimiamu, lalu foto dan unggah hasilnya di LMS sebelum deadline
kertas/ buku diKUMPULKAN SAAT HARI PERTAMA MASUK SEKOLAH ya...