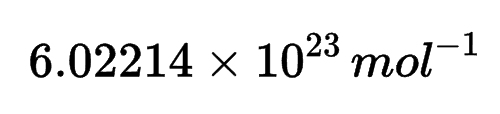Hukum Perbandingan Volume
Hukum Gay Lussac dicetuskan oleh ilmuwan asal Prancis, yaitu Joseph Gay Lussac. Lussac meneliti tentang volume gas dalam suatu reaksi kimia. Berdasarkan penelitiannya, Lusac mengambil kesimpulan bahwa perubahan volume gas dipengaruhi oleh suhu dan tekanan. Pada suhu dan tekanan tertentu, 1 liter gas nitrogen bisa bereaksi dengan 3 liter gas hidrogen menghasilkan 2 liter gas amonia. Adapun persamaan reaksinya adalah sebagai berikut.

Adapun pernyataan hukum Gay Lussac adalah sebagai berikut.
"Pada suhu dan tekanan yang sama, volume gas-gas yang bereaksi dan hasil reaksi merupakan bilangan bulat dan sederhana"